پروٹون ، الیکٹران اور نیوٹران کی تعداد کیسے تلاش کی جائے
مصنف:
Roger Morrison
تخلیق کی تاریخ:
27 ستمبر 2021
تازہ کاری کی تاریخ:
1 جولائی 2024

مواد
- مراحل
- حصہ 1 پروٹون ، الیکٹران اور نیوٹران کی تعداد کا حساب لگائیں
- حصہ 2 آئن میں الیکٹرانوں کی تعداد کا حساب لگائیں
نیوٹران ، الیکٹران اور پروٹان وہ تین اہم ذرات ہیں جو ایٹم بناتے ہیں۔ جیسا کہ آپ اندازہ لگا سکتے ہیں ، پروٹانوں میں مثبت معاوضہ ہوتا ہے ، الیکٹران منفی چارج لیتے ہیں ، اور نیوٹران صرف غیر جانبدار ذرات ہوتے ہیں۔ الیکٹرانوں کا بڑے پیمانے پر بہت چھوٹا ہے۔ تاہم ، نیوٹران اور پروٹون ایک ہی طرح کی عوام میں ہیں۔ کسی ایٹم کے پروٹون ، الیکٹران اور نیوٹران کی تعداد تلاش کرنے کے ل the ، عناصر کی متواتر ٹیبل سے مشورہ کرنا کافی ہے ، جسے مینڈیلیف کی میز بھی کہا جاتا ہے۔
مراحل
حصہ 1 پروٹون ، الیکٹران اور نیوٹران کی تعداد کا حساب لگائیں
-
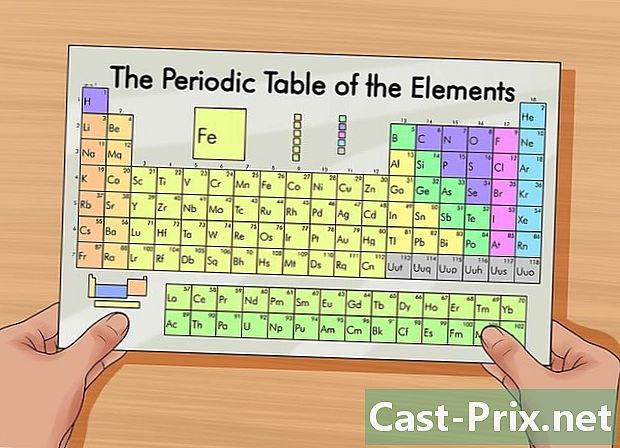
آئٹمز کی وقتا table فوقتا table ٹیبل حاصل کریں۔ یہ جدول کسی عنصر میں پروٹون ، الیکٹران اور نیوٹران کی تعداد تلاش کرنے میں آپ کی مدد کرے گا۔ یہ ایک میز ہے جو عناصر کو ان کے جوہری ڈھانچے کے مطابق پیش کرتی ہے۔ رنگین کوڈ مختلف عناصر کو ممتاز کرتا ہے۔ ہر عنصر کی شناخت ایک ، دو یا تین حرفوں پر مشتمل علامت سے ہوتی ہے۔ اس جدول میں دیگر معلومات جیسے اٹامک ماس اور ہر عنصر کی ایٹم نمبر بھی دکھائی گئی ہیں۔- آپ یہ چارٹ یا تو انٹرنیٹ پر تلاش کرکے یا کیمسٹری کی کسی کتاب میں ڈھونڈ سکتے ہیں۔
- امتحانات میں ، آپ کو عام طور پر عناصر کی متواتر جدول استعمال کرنے کی اجازت ہوگی۔
-
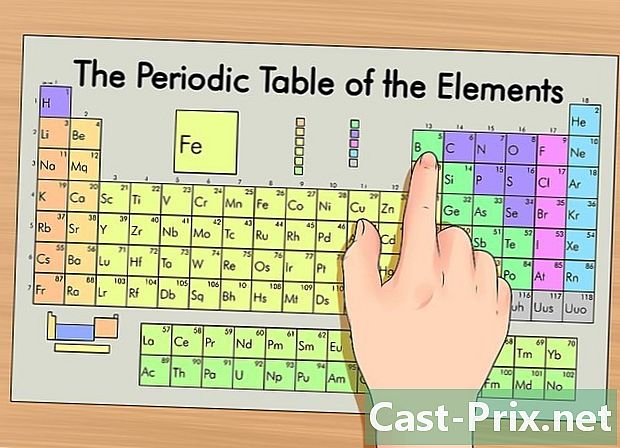
متواتر ٹیبل پر اپنے عنصر کی شناخت کریں۔ ٹیبل میں ، عناصر کو ان کے جوہری نمبر کے مطابق گروپ کیا گیا ہے۔ وہ تین اہم گروہوں میں منقسم ہیں: دھاتیں ، نون میٹالس اور میٹللوڈس (نیم دھاتیں)۔ دوسرے گروپوں میں الکلی دھاتیں ، ہالوجن اور نوبل گیسیں شامل ہیں۔- کسی عناصر کو اس کے گروپ (کالم) یا مدت (قطار) کا استعمال کرکے صف میں ڈھونڈنا آسان ہے۔
- اگر آپ عنصر کی خصوصیات کو نہیں جانتے ہیں تو ، آپ اس کی علامت تلاش کرسکتے ہیں۔
-
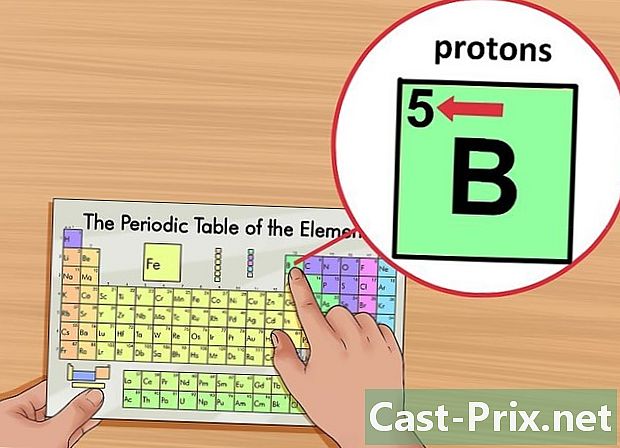
عنصر کی ایٹم نمبر تلاش کریں۔ یہ نمبر عنصر کی علامت کے اوپر ، باکس کے اوپری بائیں کونے میں نشان زد ہے۔ ایٹم نمبر آپ کو پروٹان کی تعداد دیتا ہے جو سوال میں موجود عنصر کو تشکیل دیتے ہیں۔- مثال کے طور پر ، بوران (B) کی ایٹم نمبر 5 ہے۔ لہذا ، اس میں 5 پروٹون ہیں۔
-

الیکٹرانوں کی تعداد کا تعین کریں۔ ایٹم کے نیوکلئس میں پروٹان شامل ہوتے ہیں جو مثبت چارج والے ذرات ہوتے ہیں۔ الیکٹرانوں پر منفی چارج ہوتے ہیں۔ لہذا ، غیر جانبدار عنصر کے پروٹون اور الیکٹرانوں کی تعداد ایک جیسی ہوگی۔- مثال کے طور پر ، بوران (بی) کی ایٹم نمبر 5 ہے ، لہذا اس میں 5 پروٹان اور 5 الیکٹران ہیں۔
- تاہم ، اگر یہ ایک مثبت یا منفی آئن ہے تو ، پروٹون کی تعداد اور الیکٹرانوں کی تعداد مختلف ہوگی۔ آپ کو ان کا حساب کتاب کرنا پڑے گا۔ متعلقہ شے کے بعد شیر چارج ایک چھوٹا پرنٹ میں اشارہ کرتا ہے۔
-

عنصر کے جوہری بڑے پیمانے پر تلاش کریں۔ اس اقدام سے آپ نیوٹران کی تعداد تلاش کرسکیں گے۔ آپ کو پہلے عنصر کے ایٹم ماس یا جوہری وزن کا تعین کرنے کی ضرورت ہوگی۔ یہ ڈیٹم اس عنصر کے ایٹموں کی اوسط ماس کی نمائندگی کرتا ہے۔ یہ عنصر کی علامت کے تحت لکھا ہوا ہے۔- اس عنصر کے جوہری بڑے پیمانے پر قریبی پوری تعداد کو یقینی بنائیں۔ اس طرح ، بوران کا ایٹم ماس 10،811 ہے ، لیکن آپ کو 11 کی طرف لوٹنا پڑے گا۔
-

ایٹم نمبر اور ایٹم ماس کے مابین فرق کریں۔ نیوٹران کی تعداد کا حساب لگانے کے ل you ، آپ کو جوہری تعداد اور جوہری ماس کے مابین فرق کرنا پڑے گا۔ یہ نہ بھولنا کہ آپ پہلے ہی ایٹم نمبر جانتے ہیں۔ یہ صرف پروٹانوں کی طرح ہے۔- بوران کے ل، ، آپ کے پاس: 11 (جوہری ماس) - 5 (ایٹم نمبر) = 6 نیوٹران ہوں گے
حصہ 2 آئن میں الیکٹرانوں کی تعداد کا حساب لگائیں
-

آئن کا برقی چارج تلاش کریں۔ عنصر کی علامت کے بعد یہ تعداد خارجی کے ذریعہ ظاہر ہوتی ہے۔ ایک آئن الیکٹرانوں کے اضافے یا دمن کی وجہ سے ایک مثبت یا منفی چارج والا ایٹم ہے۔ ایٹم میں پروٹون کی تعداد مختلف نہیں ہوتی۔ تاہم ، آئن میں ، الیکٹرانوں کی تعداد میں ردوبدل کیا جاتا ہے۔- چونکہ الیکٹران کا منفی چارج ہوتا ہے ، لہذا یہ ایک یا زیادہ الیکٹرانوں کے خاتمے کے بعد مثبت ہوجاتا ہے۔ دوسری طرف ، الیکٹران کا اضافہ چارج کو منفی بنانے کا اثر پائے گا۔
- مثال کے طور پر ، N کا بوجھ -3 ہے۔ دوسری طرف ، Ca کا +2 ہے۔
- یہ نہ بھولنا کہ یہ حساب کتاب ضروری نہیں ہے ، اگر عنصر کی علامت کسی پیروکار کی پیروی نہیں کرتی ہے۔
-

جوہری نمبر سے چارج کو ہٹا دیں۔ اصل میں ، ایک مثبت چارج والی آئن ایک ایٹم ہے جو الیکٹرانوں کو کھو چکی ہے۔ الیکٹرانوں کی تعداد معلوم کرنے کے ل you ، آپ کو ایٹم نمبر سے اضافی چارجز نکالنا پڑے گا۔ اگر شیر مثبت ہے تو ، پروٹون کی تعداد الیکٹرانوں سے زیادہ ہے۔- مثال کے طور پر ، Ca کا چارج +2 ہے۔ اس کے نتیجے میں ، وہ اپنی ابتدائی حالت کے مقابلے میں 2 الیکٹران کھو بیٹھا۔ کیلشیم کی جوہری تعداد 20 کے برابر ہے ، لہذا شیر میں 18 الیکٹران ہیں۔
-

منفی آئنوں کی جوہری تعداد میں چارج شامل کریں۔ جب آئن کو منفی چارج کیا جاتا ہے تو ، لیٹوم میں اضافی الیکٹران ہوتے ہیں۔ الیکٹرانوں کی کل تعداد کا حساب لگانے کے لئے ، اضافی چارجز کی تعداد کو جوہری تعداد میں شامل کرنا کافی ہے۔ اگر شیر منفی ہے تو ، اس کے پاس الیکٹران سے کم پروٹون ہیں۔- مثال کے طور پر ، N کا بوجھ -3 ہے۔ تو ، اس کی ابتدائی حالت کے مقابلے میں اس میں مزید 3 الیکٹران ہیں۔ لازوٹ کی ایٹم نمبر 7 ہے۔ لہذا ، اس آئن میں 10 الیکٹران ہیں۔

